Kennen Sie irgendjemanden, der behauptet, wir hätten einen unendlichen Vorrat an Erdöl? Wohl kaum. Aber wie kommt es dann, dass die Entwicklung der modernen organischen Chemie so eng an die Verfügbarkeit von Erdöl und seinen nachgelagerten Produkten gebunden ist? Seit mehr als 200 Jahren nimmt unsere Abhängigkeit von diesen Produkten zu. Arzneien, Pflanzenschutzmittel oder Pflegemittel werden hauptsächlich in erdölbasierten organischen Lösungsmitteln hergestellt, die nach Gebrauch ordnungsgemäß entsorgt werden müssen. In vielen Fällen bedeutet das „thermisch verwertet“, sprich: verbrannt. Dabei entsteht CO2 – und zwar eine ganze Menge davon. Trägt die Chemie also wesentlich zum Klimawandel bei? Verraten Sie es keinem, aber: ja!
Dabei ist es gar nicht so schwer, das zu ändern. Die dafür nötigen wissenschaftlichen Erkenntnisse liefert schon heute die Biologie, die auf Wasser basiert. Die Vorteile liegen auf der Hand: Wir haben die Chance, die Verschmutzung der Umwelt zu minimieren und sicherzustellen, dass auch künftige Generationen die Ressourcen des Planeten nutzen können. Ökologisches Handeln ist in diesem Fall auf allen Ebenen und für jeden ein Gewinn.
DIE SUCHE NACH DEM REAKTIONSGEFÄSS
Wie organische Chemie in Wasser funktioniert, ist kein Geheimnis. Die Erklärung ist eigentlich schon seit Milliarden von Jahren sichtbar und dennoch im Verborgenen geblieben. Die Natur selbst zeigt, wie es geht: Ohne die Synthese komplexer, wasserunlöslicher Biomoleküle wie Polypeptiden oder Vitaminen unter wässrigen Bedingungen könnte kein Leben existieren. Die Kraft der „Chemie im Wasser“ ist also etwas, das wir jeden Tag am eigenen Leib erfahren. Im großen Maßstab lässt sich „Chemie im Wasser“ auch beobachten, wenn Ölkonzerne Meeresverschmutzungen beseitigen. Es ist also offensichtlich: Das Know-how ist zumindest konzeptionell bereits vorhanden. Warum hat die organische Synthese dann so lange gebraucht, um sich anzupassen?
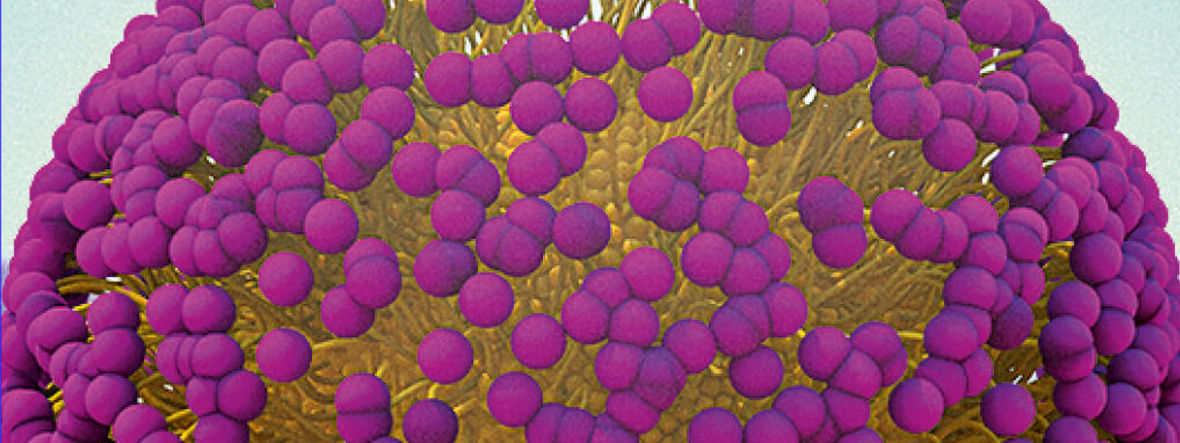
Die Herausforderung liegt darin, passende „Reaktionsgefäße“ für wasserunlösliche Biomoleküle zu finden. Die Natur setzt seit jeher auf eine Vielzahl von Membranen, Vesikeln und mizellaren Anordnungen in Wasser. Könnte die industrielle Lösung ebenso einfach sein? Ja und nein. Die gute Nachricht ist, dass organische Synthese in derartigen Reaktoren prinzipiell möglich sein sollte. Die Reaktanten wären darin untergebracht, ebenso wie die Katalysatoren, die diese Reaktionen beschleunigen. Ein weiterer Vorteil ist, dass diese Arten von Biomolekülen nicht „nachdenken“: Deshalb können sie alle möglichen Produkte herstellen. Anders als Enzymen ist ihnen egal, was zur Reaktion kommt und welche Stoffe gebildet werden.
Die schlechte Nachricht ist, dass ein Nanoreaktor gefunden werden muss, der für die organische Synthese geeignet ist: Er muss in der Lage sein, viele verschiedene Arten von Chemie zu beherbergen, wie sie von der Spezialchemieindustrie und insbesondere von Pharma- und Agrochemieunternehmen routinemäßig verwendet werden.
Das „Tal des Todes“, das sich für die Forschung jahrhundertelang auftat, ist die Lücke zwischen der Erkenntnis, dass wir eine Technologie für organische Chemie im Wasser benötigen, und der Lösung dieses Problems. Wir müssen verstehen, dass die Lösung in den Nanoreaktoren besteht, die sich „im Wasser“ befinden. Die eigentliche Chemie mit wasserunlöslichen Reaktanten und Katalysatoren findet im inneren Kern statt, der für verschiedene Reaktionen wie ein Lösungsmittel funktioniert.
Die für die Spezialchemie spannenden Moleküle sind in der Regel recht komplex. Daher müssen auch die Werkzeuge zu ihrer Herstellung vergleichsweise ausgeklügelt sein. Neue Tenside mit einem Anteil von nur wenigen Gewichtsprozent an einem wässrigen Medium sollten schon durch ihre Gestaltung umweltverträglich sein und zugleich die effiziente Durchführung vieler Reaktionen ermöglichen.

Prozesse in der modernen Synthese, insbesondere solche mit übergangsmetallkatalysierten Reaktionen, die diesen Ansprüchen genügen, müssen viele der zwölf Prinzipien der Grünen Chemie erfüllen, die 1998 von den US-Wissenschaftlern Paul Anastas and John Warner verfasst wurden. Gibt es in der Literatur zur mizellaren Katalyse irgendwelche Hinweise, Hintergründe oder Präzedenzfälle, die der organischen Chemie bei der Umstellung auf Wasser helfen? Leider nein.
Dabei existiert beträchtliches Vorwissen über die Katalyse in Mizellen. Die Nutzung durch die Spezialchemieindustrie war aber bisher bestenfalls ein Zufallsprodukt. Erst in den vergangenen 15 Jahren haben viele Experimente nach dem Prinzip von Versuch und Irrtum zu einem besseren Verständnis des Designs geeigneter Tenside geführt. Auf dieser Basis entwickelte sich das Feld der mizellaren Katalyse, mit einem immer größeren Werkzeugkasten unterschiedlicher Technologien. Damit lässt sich heute so gut wie jede Reaktion in Wasser durchführen.

»Mit der mizellaren Katalyse lässt sich heute so gut wie jede Reaktion in Wasser durchführen.«
Bruce Lipshutz Vorreiter der grünen Chemie
Das führende „Designertensid“ ist bis heute TPGS-750-M. Es gliedert sich in drei Teile: Der im Wasser nach außen gewandte, hydrophile Teil enthält den Baustein Methoxy-Polyethylenglykol 750 (MPEG 750). Der innere oder lipophile Teil besteht aus dem chemischen Grundstoff Vitamin E. Verbunden werden die beiden Bausteine durch einen Bernsteinsäurelinker. Jeder einzelne Bestandteil dieses Designertensids ist also harmlos – oder ist, wegen des enthaltenen Vitamins E, sogar gesund.
SCHNELLER, ÖKOLOGISCHER, WIRTSCHAFTLICHER
Das mizellenbildende Amphiphil TPGS-750-M wird für viele verschiedene Reaktionen eingesetzt. Dazu gehören solche, die durch Palladium katalysiert werden, ebenso die Bildung von Amid-/Peptidbindungen und die nukleophile aromatische Substitutionsreaktion (SNAr), die traditionell in organischen Lösungsmitteln durchgeführt wurden.
Zusätzlich zu den ökologischen und wirtschaftlichen Vorteilen führen die höheren Substrat- und Katalysatorkonzentrationen in den inneren Kernen der Mizellen zu beschleunigten Reaktionen. Außerdem bieten sie die Möglichkeit, Edelmetallkatalysatoren in besonders niedrigen Konzentrationen einzusetzen. Bereits einige millionstel Teile eines Katalysators können ausreichen.
Die Endprodukte, die in diesen Reaktionen entstehen, sind meist wasserunlösliche Feststoffe. Sie fallen im wässrigen Medium aus. Einfaches Filtrieren reicht, um sie abzutrennen. Und was ist mit dem Filtrat, dem wässrigen Medium, das oft den Katalysator enthält? Es wird recycelt. So einfach ist das!
Wenn wir bereits über das Know-how verfügen, die begrenzten Ressourcen unseres Planeten besser zu nutzen – was spricht dann dagegen, mit weniger mehr zu erreichen? Die größere Frage ist vielleicht, ob die chemische Industrie entschlossen genug ist, diese Veränderungen vorzunehmen. Wir wollen es hoffen. Nachhaltigkeit ist nicht nur ein Modewort. Sie hat enorme Auswirkungen. Sie ist unsere Zukunft.